Préparation à base de plantes, quel solvant choisir ?
Même si nous aimons la poésie, lorsque nous devons utiliser les plantes médicinales pour profiter de leurs bienfaits, la première question que l’on se pose est le choix du solvant. L’eau, l’alcool, le vinaigre, l’huile, etc … ?
Ces différents solvants ont des propriétés différentes, et ils n’ont pas tous la même capacité d’extraire les principes actifs de nos plantes.
L’une des caractéristiques importantes à prendre en compte est la polarité de notre solvant ainsi que des molécules responsables des merveilles propriétés médicinales que les plantes nous offrent. On regarde également la viscosité et le ph de notre solvant, et l’on tiendra compte également du temps de macération et de la température.
Dans cet article je vous partage des notions un peu plus complexes de phytochimie, et particulièrement les notions de polarité, car la phytochimie est à mon sens essentielle à intégrer dans notre pratique pour réaliser des préparations à base de plantes de qualité, et faire honneur à nos belles alliées végétales, mais aussi aux personnes qui vont utiliser nos belles préparations.
Avec un peu de pratique on peut vite acquérir de bonnes bases pour approfondir la chimie verte et il devient passionnant d’explorer l’infiniment petit de la phytochimie !
Qu’est-ce qu’une extraction ?
Une extraction consiste à utiliser un solvant (eau, alcool, glycérine, vinaigre, huile) dans lequel on va immerger une plante pour tenter d’en extraire des molécules (responsables des principes actifs) qui vont se dissoudre dans ce solvant.
Ce procédé va engendrer ce que l’on appelle des liaisons chimiques.
Les liaisons chimiques entre atomes ne sont pas des liaisons solides; ce sont des liaisons électrostatiques. Pour se lier entre eux, les atomes vont déplacer leurs électrons et ils vont se les partager.
Quand deux atomes vont attirer le même électron, ils vont se rapprocher et se « lier ». La capacité d’un atome à attirer un électron est appelée l’électronégativité.
Tous les atomes recherchent la stabilité. C’est ce qui va les forcer à faire des liaisons avec d’autres atomes.
Il y a deux types de liaisons: la liaison covalente, que l’on peut qualifier de « partage » d’électrons entre atomes, et la liaison ionique, qui est comparable à un « don » d’électrons. Je ne vais pas aborder ici les liaisons ioniques, car le sujet est déjà bien assez complexe, mais nous allons mettre le focus sur les liaisons covalentes afin d’aborder les notions de polarités.
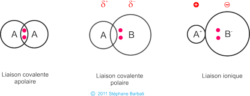
Notions de polarité
Il y a donc plusieurs éléments dont il faut tenir compte lorsque l’on veut choisir un solvant pour y faire macérer une plante, à commencer par la polarité de notre solvant et des molécules de nos plantes.
Qu’est-ce que la polarité ?
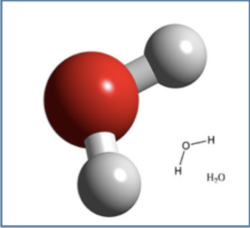 Pour faire simple, c’est la charge électro-magnétique d’une atome, sachant que plusieurs atomes constituent des molécules, comme par exemple l’H2O, molécule d’eau composée d’un atome d’oxygène et de deux atomes d’hydrogène (voir photo). L’eau est très souvent utilisée en herboristerie, pour réaliser de belles infusions par exemple. L’eau est une molécule très polaire et très gourmande qui aime attirer à elle des électrons, elle va donc attirer à elle de nombreuses autres molécules polaires également. Elle attirera par contre bien moins les molécules non polaires, comme tout ce qui est huileux, raison pour laquelle l’eau et l’huile ne sont pas miscibles.
Pour faire simple, c’est la charge électro-magnétique d’une atome, sachant que plusieurs atomes constituent des molécules, comme par exemple l’H2O, molécule d’eau composée d’un atome d’oxygène et de deux atomes d’hydrogène (voir photo). L’eau est très souvent utilisée en herboristerie, pour réaliser de belles infusions par exemple. L’eau est une molécule très polaire et très gourmande qui aime attirer à elle des électrons, elle va donc attirer à elle de nombreuses autres molécules polaires également. Elle attirera par contre bien moins les molécules non polaires, comme tout ce qui est huileux, raison pour laquelle l’eau et l’huile ne sont pas miscibles.
L’eau est également une petite molécule, et va pouvoir s’infiltrer facilement entre les cellules.
![]() L’huile, à la différence, est un solvant totalement non polaire. L’huile est en effet composé de grosses molécules de triglycérides avec seulement quelques atomes d’oxygène « coincés » au milieu de plusieurs atomes de carbone. Ainsi l’oxygène, qui est très électronégatif, donc très instable et qui a facilement envie de se lier, ne peut pas se lier à d’autres molécules car il est pris entre de nombreux atomes de carbone qui eux sont très stables et ne vont pas chercher à faire de nouvelles liaisons.
L’huile, à la différence, est un solvant totalement non polaire. L’huile est en effet composé de grosses molécules de triglycérides avec seulement quelques atomes d’oxygène « coincés » au milieu de plusieurs atomes de carbone. Ainsi l’oxygène, qui est très électronégatif, donc très instable et qui a facilement envie de se lier, ne peut pas se lier à d’autres molécules car il est pris entre de nombreux atomes de carbone qui eux sont très stables et ne vont pas chercher à faire de nouvelles liaisons.
Ainsi, il n’y a pas débalancement de charge, et donc pas de nouvelles liaisons entre molécules, ce qui de l’huile un solvant assez médiocre car ses molécules ne vont pas chercher à se lier aux molécules de nos plantes facilement. Pour cette raison, il est nécessaire de chauffer légèrement la préparation, et de mélanger régulièrement, ceci afin d’augmenter la possibilité de rencontres et d’échanges entre les molécules. Tandis que l’eau aura plutôt une action d’attirer les molécules à elle comme une sorte « aimant », l’huile, elle, n’agira pas tant comme tel et aura plutôt une action d’accueillir, de recevoir, ainsi certaines molécules vont plutôt se déposer en suspension, sans vraiment se lier à l’huile. C’est un phénomène que l’on voit très bien par exemple avec les mucilages, ceux-ci ne sont pas mélangés à l’huile et restent en suspension.
 L’alcool et l’acide acétique pure ( présent dans le vinaigre) , quand à eux, auront une polarité moindre que l’eau, mais quand même importante. Cependant, en herboristerie on ne les utilise jamais pur. Le vinaigre par exemple oscille entre 5 et 9% d’acide acétique, le reste est composé d’eau, ainsi sa polarité sera influencée par sa grande teneur en eau. Le vinaigre se lie par ailleurs très bien avec les bases, comme les minéraux, ou certains alcaloïdes formant des sels d’alcaloïdes.
L’alcool et l’acide acétique pure ( présent dans le vinaigre) , quand à eux, auront une polarité moindre que l’eau, mais quand même importante. Cependant, en herboristerie on ne les utilise jamais pur. Le vinaigre par exemple oscille entre 5 et 9% d’acide acétique, le reste est composé d’eau, ainsi sa polarité sera influencée par sa grande teneur en eau. Le vinaigre se lie par ailleurs très bien avec les bases, comme les minéraux, ou certains alcaloïdes formant des sels d’alcaloïdes.
Dit autrement …
Qu’est-ce qu’une molécule non polaire ?
Une molécule non polaire est une molécule dont les électrons sont distribués de façon égale, équitable, et qui n’engendre pas de déplacement de charges électrique « résiduelle ». L’huile est composée de longues chaînes de carbone très stable, qui n’engendre pas de débalancement de charge, et sera donc un solvant non polaire.
Qu’est-ce qu’une molécule polaire ?
Une molécule polaire est une molécule dont les électrons sont distribués de façon inégale, créant ainsi un débalancement de la charge électrique dans une direction. Cette force exerce une attraction un peu comme un aimant.
L’eau est un solvant polaire. L’eau est une toute petite molécule contrairement à l’huile, composée d’un atome d’oxygène et de deux atomes d’hydrogène, et elle va pouvoir s’infiltrer partout et attirer à elle différentes autres molécules. Cette petite molécule est très instable car sa charge électromagnétique est fortement débalancée, elle va donc attirer fortement à elle toutes sortes de molécules polaires qui vont également chercher à se compléter et ainsi chercher à stabiliser leur charge électromagnétique.
Nous avons abordés l’huile, et l’eau. Pour comprendre les différences de polarité de nos solvants, on peut leur attribuer une valeur arbitraire (1), ainsi nous plaçons la polarité de l’eau à 1, et celle de l’huile à 0.
L’éthanol et l’acide acétique on un degré de polarité similaire, situé entre les deux : 0,65.
Ces valeurs sont totalement arbitraires et nous permettent juste d’avoir une base sur laquelle comprendre les différentes notions de polarité.
On voit que pour l’éthanol et l’acide acétique pur, ces solvants se situent à un degré de polarité qui va permettre d’extraire à la fois des molécules polaires et non polaires.
Mais qui utilise de l’acide acétique pur ?
Personne ! Nous utilisons du vinaigre avec en général 5 à 8% d’acide acétique, le reste étant de l’eau.
La polarité d’un vinaigre de pomme par exemple va donc fortement être modifiée, et se rapprochera de la polarité de l’eau, avec une toute petite tendance à extraire quelques molécules non polaire, comme certaines huiles essentielles par exemple. Par contre, l’acide acétique contenu dans un vinaigre va très bien réagir avec les bases, autrement dit les minéraux, c’est pour cela que l’on dit que le vinaigre extrait bien les minéraux de nos plantes reminéralisantes comme l’ortie.
La présence d’azote dans le vinaigre lui procure également une affiné spécifique avec certains alcaloïdes, c’est encore une fois l’une des raisons pour laquelle le vinaigre est utilisé avec certaines plantes dont on veut extraire les alcaloïdes comme l’allantoïne de la consoude, qui n’est par ailleurs pas du tout bien extraite dans l’huile et très peu dans l’alcool.
Concernant l’alcool, ici aussi, en herboristerie nous utiliserons parfois de l’alcool « pur » (à 96%) pour des plantes fraîches, parfois de l’alcool de fruits autour de 45° pour des plantes sèches, et le degré d’alcool va très fortement influencer les molécules qui vont être extraites puisque la polarité va être modifiée par la présence d’eau.
Un alcool à 45% sera beaucoup plus polaire qu’un alcool à 96%.
Polarité relative des solvants
| SOLVANT | POLARITE RELATIVE |
|---|---|
| eau | 1 |
| Glycérine pur | 0.81 |
| Ethanol pur | 0.65 |
| Acide acétique | 0.65 |
| Huile | 0 |
• Avantage de l’eau : l’eau est une molécule très petite, qui ne contient pas de carbone, ce qui change donc sa force : elle ne partage pas ses électrons, elle garde tout pour elle !
• L’huile n’agit pas par phénomène « d’aimant », mais plutôt par phénomène de dispersion. L’huile ne va pas chercher les molécules, elle les accueille.
• Certains solvants comme l’éthanol et l’acide acétique sont rarement purs, et donc la polarité va changer en fonction du pourcentage d’alcool.
Exemple pour un vinaigre à 5 % d’acide acétique :
Acide acétique : 5% x 0,65 / 100 % = 0,032
Eau : 95 % x 1 / 100 % = 0,95
Mélange : 0,032 + 0,95 = 0,982
La polarité d’un vinaigre est de 0,98 % et donc assez proche de la polarité de l’eau.
L’alcool pur est également hygroscopique, comme la glycérine et le miel. Qu’est-ce que cela veut dire ? Cela signifie que ces solvants vont attirer fortement l’eau, c’est l’une des raisons pour laquelle il peut être parfois préférable d’utiliser des plantes fraîches, contenant de l’eau, car il va y avoir une force d’attraction intéressante qui va plus facilement briser les parois cellulaires des plantes.
Ce qui est tout l’inverse de l’eau en tant que solvant, qui va plus facilement extraire les molécules des plantes qui sont déjà séchées.
On ne pourra pas définir l’alcool et le vinaigre de solvants polaires ou non polaires, il est impossible de les catégoriser de la sorte. En phytochimie, on parle de TENDANCE polaire ou non polaire, car cela va dépendre d’un très grand nombre de paramètres.
| LES MODÈLES D'EXTRACTION PAR POLARITÉ NE SONT PAS PARFAITS ! |
Il est également important de regarder le ph et la viscosité du solvant, de tenir compte de la température, de l’usage de plantes fraîches ou sèches selon les possibilités, de l’effet que l’on recherche… Si l’on veut prioriser l’amertume d’une plante pour par exemple stimuler la digestion, il faudra veiller à utiliser un solvant que l’on pourra garder quelques secondes en bouche afin d’activer les sucs digestifs nécessaire à la production d’acide chlorhydrique au sein de l’estomac.
Néanmoins vous pouvez déjà retenir ces quelques informations et vous questionnez sur les différents principes actifs que vous cherchez à extraire et quels sont les solvants les plus appropriés.
Chaque plante est unique et mérite d’être valorisée de la meilleure façon qu’il soit. C’est primordial pour réaliser des remèdes efficaces et comprendre en profondeur comment les plantes vont agir dans notre corps en fonction de la préparation que nous aurons choisi. Une fois que vous comprenez ces notions de base, c’est un univers fascinant qui s’offre à nous et nous permet de comprendre en profondeur la vie intime de chaque plante et la façon dont son énergie danse dans chacune de ses cellules pour nous révéler sa singularité et sa médecine.
Si ces informations vous semblent pertinentes et utiles, n’hésitez pas a partager autour de vous. Je reçois souvent de nombreuses questions, et je pense que ces notions de phytochimie méritent d’être vulgarisées et accessibles !
Sources
Pharmacognosie, Jean Bruneton
Chimie organique, Paula Yurkanis Bruice
(1) Herbal Constituants, Lisa Ganora

2 commentaires
Très bien expliqué, merci pour ces informations précieuses.